Müsst Ihr nicht verstehen .. aber bin für jeden Tipp dankbar
Ich stelle hier mal für mich zwei Links und Texte rein ... der erste über Insulin, wo aber nichts dabei steht, wie genau das mit den Myoglobinspeichern in der Muskulatur zusammenhängt.
Der zwetei über die Funktionsweise der Muskeln, wo ganz unten was drüber steht, wie eine Myopathie ehtsteht.
Der dritte über Myoglobin. Myoglobin transportiert nicht Glucose, speichert auch keine Glucose, sondern Sauerstoff .. dritter Link ist einer darüber, was Myoglobin eigentlich tut.
Bin noch vollkommen ratlos, wie das zusammenhängt, möchte diese drei Sachen hier nur mal zusammen reinstellen, damit ich das, sollte mein Hirn mir da später mal weiterhelfen, die Lösung zu entdecken, dann zusammenhängend wiederfinde.
Siehe unten:
LG Renate
Funktion und Wirkung
Die Regulation der Konzentration von
Glukose im Blut erfolgt durch einen
Regelkreis aus zwei Hormonen, die abhängig von der Blutzuckerkonzentration ausgeschüttet werden. Insulin ist das einzige
Hormon, das den Blutzuckerspiegel senken kann. Sein Gegenspieler ist das
Glucagon, dessen Hauptaufgabe es ist, den Blutzuckerspiegel zu erhöhen. Auch
Adrenalin,
Kortisol und
Schilddrüsenhormone haben blutzuckersteigernde Wirkungen.
Der
Blutzuckerspiegel steigt vor allem nach der Aufnahme von
kohlenhydratreicher Nahrung. Als Reaktion darauf wird von den β-Zellen Insulin
ins Blut ausgeschüttet. Insulin senkt den Blutzuckerspiegel dadurch, dass es mittels seiner „Schlüsselfunktion“ der Glukose aus dem
Blutplasma und der
Gewebsflüssigkeit den Durchtritt durch die
Zellmembran in das
Zellinnere ermöglicht. Vor allem die
Leber- und
Muskelzellen können in kurzer Zeit große Mengen Glukose aufnehmen und sie in Form von
Glykogen speichern oder in
Energie umwandeln (siehe
Glykolyse).
Auch auf andere Zellen wirkt das Hormon, so hat es Einfluss auf den
Fett- und
Aminosäurestoffwechsel sowie auf den
Kaliumhaushalt.
Das Hormon ist wesentlicher Faktor folgender Erkrankungen:
Animation der Tertiärstruktur von Insulin
Das im Blut zirkulierende Insulin entfaltet seine Wirkung durch Bindung an Insulinrezeptoren.
Insulinrezeptor
Letztlich löst die Bindung dieses Hormons an seinen
Rezeptor eine Reihe von
Kinase-
Kaskaden (Kaskade von
Phosphorylierungsreaktionen) aus, die durch
Signalwege beschrieben werden können.
[2]
Diese Signalwege bewirken ein Sinken des Blutglucosespiegels durch
Dieses Signal wird durch die Aktivierung glucoseverbrauchender Wege
unterstützt. Weitere unterstützende Maßnahmen bestehen in der
Unterdrückung glucoseliefernder Wege, so zum Beispiel durch Abbau des
second messenger cAMP über eine
Phosphodiesterase.
Glukoseaufnahme im Muskelgewebe
Das Hormon erhöht in der Muskulatur und im Fettgewebe die
Permeabilität
(Durchlässigkeit) der Zellmembran für Glucose. Dabei ist zu beachten,
dass nicht die Membran selbst permeabler wird, sondern dass vermehrt
Carrier-Proteine für Glucose aktiviert werden. Dieses Carrier-Protein ist GLUT4, ein hochaffiner, insulinabhängiger Glucose-
Transporter, welcher die Glucose durch erleichterte
Diffusion (passiver Transport) in die Zelle transportiert. Folgende physikalische Eigenschaften sind für GLUT4 relevant:
sättigbar, nicht aktivierbar oder inaktivierbar, also Regulation nur durch insulinabhängigen Einbau oder Ausbau.
Glukoseaufnahme und Stoffwechsel im Gehirn
Nervenzellen (und
Erythrozyten) nehmen Glucose insulin
unabhängig
auf. Deshalb nehmen die insulinabhängigen Zellen bei einem erhöhten
Insulinspiegel mehr Glucose auf, und für die insulinunabhängigen bleibt
weniger übrig.
Im Allgemeinen besteht bei
Hypoglykämie
die Gefahr, dass das auf Glucose angewiesene Nervensystem geschädigt
wird. Beachtenswert ist der Effekt, dass Insulin, verabreicht als
Nasenspray in direktem Kontakt mit dem
ZNS, die
Alzheimer-Krankheit positiv beeinflusst.
[3]
Auf- und Abbau von Fettgewebe
Das Hormon hemmt die
Lipolyse im
Fettgewebe und somit den Abbau von
Fett. Ein Insulinmangel führt daher zu einer gesteigerten Lipolyse mit Bildung von
Ketokörpern und einer daraus resultierenden
Ketose.
Förderung des Zellwachstums
Eine weitere zentrale Funktion des
Peptidhormons Insulin besteht in der Regulation von Zellwachstum und
Proliferation
durch die Aktivierung der Transkription von Genen, die für Kontrolle
und Ablauf des Zellzyklus von großer Bedeutung sind. Diese
Insulinwirkung ist bei
Diskursen über Insulinpräparate ein Thema.
Tryptophan-Aufnahme im Gehirn
Höhere Insulinspiegel haben einen leicht steigernden Einfluss auf die Aufnahme von
Tryptophan ins Gehirn.
[4]
Insulin und die Regelung des Blutzuckerspiegels
Vereinfachte Darstellung der Signalkaskade für Insulin zum Aufbau von Glykogen (Einzelheiten im Text)
Eine der wichtigsten biologischen Wirkungen des Insulins ist die
rasche Beschleunigung der Glucoseaufnahme in Muskel- und Fettzellen und
Regulierung der Zwischenspeicherung in der Leber im Rahmen der Regelung
des
Blutzuckerspiegels:
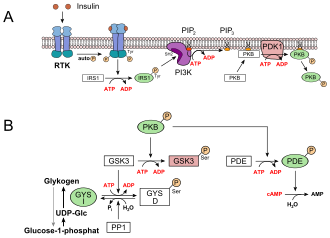
- In der Leber und der Muskulatur werden die mit der Nahrung aufgenommenen Kohlenhydrate als Glykogen gespeichert. Dies hat ein Absinken der Glucosekonzentration im Blut zur Folge. Die Glucoseaufnahme in die Leberzellen erfolgt insulinunabhängig über GLUT2. Durch Insulin wird eine Rezeptor-Tyrosinkinase (RTK) aktiviert, die eine Signaltransduktion in Gang setzt. Beteiligt sind dabei das Insulinrezeptorsubstrat 1 (IRS1), die Phosphoinositid-3-Kinase (PI3K), der second messenger Phosphatidylinositol-4,5-bisphosphat (PIP2), die Phosphoinositid-abhängige Kinase-1 (PDK1) und schließlich die Proteinkinase B (PKB) (siehe Bild, A). PKB phosphoryliert die Glykogensynthase-Kinase 3, GSK3, die dadurch inaktiviert wird. GSK3 ist eine Kinase, die die Glykogensynthase phosphoryliert und damit inaktiviert (GYS b). GSK3 steht in Konkurrenz zu einer Phosphatase, der Protein-Phosphatase 1
(PP1). Dadurch, dass GSK3 nicht mehr wirken kann, liegt daher immer
mehr Glykogensynthase in seiner dephosphorylierten Form vor (GYS a,
siehe unteres Bild, B). Außerdem aktiviert die PKB eine
Phosphodiesterase, PDE, die cAMP zu AMP hydrolysiert. Infolgedessen
erlischt zusätzlich der Signalweg für die Proteinkinase A, die für den Abbau von Glykogen sorgt.
- In der Leber, dem Fettgewebe und der Muskulatur wird unter Insulineinfluss die Triglyceridsynthese stimuliert. Substrate dafür sind neben den Kohlenhydraten mit der Nahrung aufgenommene Lipide.
- In den drei genannten Geweben werden Aminosäuren verstärkt aufgenommen und für die Proteinsynthese verwendet.
Die
metabolischen und
mitogenen
Effekte von Insulin werden über die Bindung an dessen Rezeptor auf der
Zelloberfläche der Zielgewebe Leber, Muskel und Fett initiiert.
- Insulin induziert weiterhin die Glykogensynthese
und -speicherung in Leber und Muskel, die Triglyceridsynthese in Leber
und Fettgewebe sowie die Speicherung von Aminosäuren im Muskel.
- Gleichzeitig hemmt Insulin die hepatische Gluconeogenese und zählt daher insgesamt zu den wichtigsten Regulatoren des Glucosemetabolismus.
Gegenspieler
Fällt der Blutzuckerspiegel im Körper unter einen Wert von 80 mg/dl ab, wird die Insulinproduktion bereits stark reduziert.
Sinkt der Blutzucker weiter ab, treten verschiedene Gegenspieler des Insulins auf:
Die Spiegel dieser gegenregulierenden Hormone steigen bereits deutlich an, wenn der Blutzucker unter 60 mg/dl absinkt.
Beim Typ 1-Diabetes ist oft auch der Gegenregulationmechanismus gestört, was zu zusätzlichen Problemen mit
Hypoglykämien führt.
Somatostatin hat einen hemmenden Einfluss auf die Sekretion von Insulin und Glucagon, da er als allgemeiner
Hemmer im Körper fungiert.
Vorkommen
Insulinsequenzen von mehr als 100 verschiedenen
Spezies sind bekannt. Die
Proteinsequenzen der jeweiligen Insuline sind sich ähnlich – sie zeigen
Sequenzhomologie – sind aber nicht identisch.
[5]
Über die Unterschiede im chemischen Aufbau von Humaninsulin gegenüber
den Insulinen einiger Säugetiere sowie Informationen zu künstlich
hergestelltem Insulin siehe
Insulinpräparat.
Insulin und
Evolution:
Genotypen, die in
Jäger- und Sammlergesellschaften einen raschen Abbau von Energiereserven bei Nahrungsmangel verhinderten,
prädisponieren beim heutigen Lebensstil mit
Bewegungsmangel und Nahrungsüberangebot zu
Adipositas und Typ-2-Diabetes.
[6]
Inwieweit
Gene den Glukosestoffwechsel und die damit verbundene Wirkung von Insulin beeinflussen, ist noch nicht zur Gänze geklärt.
[7]
Bildung, Speicherung, Freisetzung und Regulierung
Biosynthese
Die
Synthese des Hormons erfolgt in den β-Zellen der Langerhansschen Inseln der
Bauchspeicheldrüse. Die
genetische Information wird von nur einem
Genlocus im kurzen
Arm des
Chromosom 11 codiert. Das Gen besteht aus ungefähr 300
Nukleotiden.
[8][9]
Die
mRNA wird zunächst an
Ribosomen, die sich auf dem rauen
endoplasmatischen Retikulum (ER) befinden, in das Präproinsulin
translatiert, das aus 110 Aminosäuren besteht.
Die weitere
Prozessierung erfolgt in zwei Schritten, nach der
Faltung des
Moleküls durch Bildung von
Disulfidbrücken entsteht durch Abspaltung von
Signalpeptid und C-Peptid das Insulinmolekül.
1) Die Abbildung zeigt das Präproinsulin-Molekül[10] mit 110 Aminosäuren, bestehend aus:
-
- einer Signalsequenz (leader peptide, im Bild L) mit 24 Aminosäuren,
- an die sich die 30 Aminosäuren der B-Kette anschließen,
- danach kommen zwei Aminosäuren und das C-Peptid (connecting peptide, im Bild C) mit 31 Aminosäuren,
- gefolgt von weiteren zwei Aminosäuren und der A-Kette mit 21 Aminosäuren.[11]
2) Faltung
- Durch Bildung von drei Disulfidbrücken (zwei zwischen dem A- und
B-Peptid, eine innerhalb des A-Peptids) wird das bisher gestreckte
Molekül gefaltet.
3) das gefaltete Präproinsulin-Molekül.
4) Abspaltung von Signalpeptid und C-Peptid:
-
5) das Insulin-Molekül:
- Es besteht aus zwei Peptidketten, der A-Kette mit 21 und der B-Kette mit 30 Aminosäuren, welche durch zwei intermolekulare Disulfidbrücken kovalent verbunden sind (Cys-A7 mit Cys-B7 und Cys-A20 mit Cys-B19). Eine dritte intramolekulare Disulfidbrücke verbindet die Cysteinreste der Positionen 6 und 11 der A-Kette.
|
|
Schematische Darstellung (Topologiemodell) von Proinsulin (B-Kette
orange, A-Kette grün, C-Peptid grau). Das C-Peptid wird
herausgeschnitten. Das Signalpeptid des Präproinsulins ist nicht
dargestellt.
|
Speicherung
Hexamer aus Insulinmolekülen
Die Insulinmoleküle werden in den
Vesikeln des
Golgi-Apparats, der an der Zellmembran der β-Zelle liegt, durch
Zink-
Ionen zu
Hexameren gebunden und so stabilisiert gespeichert (
Zink-Insulin-Komplex).
Die hohe Bindungsfreudigkeit von Insulinmolekülen an Zink hat mehrere
wichtige Auswirkungen. Insulin ist in der Form von Hexameren und nach
dem Zerfall in
Dimere noch nicht wirksam, sondern nur als Einzelmolekül. Diese Eigenschaft spielt bei den
Insulinpräparaten eine wichtige Rolle. Bei schnellwirkenden Insulin
präparaten
ist der zu langsame Zerfall der Molekülverbände unerwünscht und es wird
nach Möglichkeiten gesucht den Zerfall zu beschleunigen. Bei
langwirkenden Insulinpräparaten wird die Zinkbindung zur Verlängerung
der Wirkdauer durch hohe Zink
konzentrationen
gezielt verstärkt. Bei der Entwicklung von oralen Insulinpräparaten
wird die Zinkbindung zur Kopplung von Insulin an Transportmoleküle
genutzt.
Ausschüttung
Oszillierende Insulinausschüttung
Spiegel von Insulin, Glucagon und GLP-1 nach einer Mahlzeit bei
Stoffwechselgesunden. Der Blutzuckerverlauf entspricht etwa der Kurve von GLP-1.
Die Ausschüttung von Insulin ins Blut erfolgt durch
Exozytose.
Die Insulinausschüttung erfolgt
oszillierend. Alle drei bis sechs Minuten wird Insulin in die
Blutbahn
abgegeben. Nach der Nahrungsaufnahme ist bei Stoffwechselgesunden ein
biphasischer Verlauf der Insulinsekretion feststellbar: Der erste
„Insulin
peak“
hat seine Spitze nach drei bis fünf Minuten und dauert zehn Minuten.
Danach schließt sich eine zweite Phase an, die so lange anhält, wie eine
Hyperglykämie besteht.
[12] Die erste Phase besteht aus den gespeicherten Insulinmolekülen, die zweite Phase vor allem aus neu gebildetem Insulin.
[13]
Das C-Peptid wird erst bei Anstieg des Blutzuckerspiegels aus dem Proinsulin durch
Peptidasen
herausgeschnitten und gemeinsam mit dem aktiven Insulin und Zink
ausgeschüttet. Durch den Nachweis von C-Peptid im Serum kann die
endogene
Insulinproduktion gemessen werden. So kann bei Diabetikern eine Aussage
darüber getroffen werden, wie viel Insulin noch vom Körper selbst
hergestellt wird, da das synthetische Produkt keine C-Sequenz enthält.
[14]
Regulierung
Die
Hauptaufgabe von Insulin besteht darin, im Zusammenwirken mit Glukagon
den Blutglukosespiegel ständig zwischen bestimmten Werten zu halten.
Gerät der Blutzuckerspiegel unter einen gewissen Wert droht das
hypoglykämische Koma und der Tod, gerät er darüber, drohen Schäden an
Gefäßen, Nierenkörperchen und anderen Geweben. Zusammen mit
Leptin scheint Insulin aber auch maßgeblichen Anteil an der Energie
homöostase
zu haben. Dabei wirkt aber nicht nur Leptin auf Insulin ein, sondern
das Insulin wirkt selbst ebenfalls auf das Leptin ein, genau auf die
Aufnahme von Leptin im Gehirn.
Aufgrund der lebenswichtigen Funktion muss die biochemische
Implementierung des Regelkreises robust sein. Da Zellen nicht „denken“
können, kann es nur so sein, dass Einzelzellen wie ein Zustandsautomat
funktionieren bzw. dass wenige Zellen dermaßen zusammenwirken, dass ein
Reiz sinnvoll verrechnet wird.
Der Haupt
reiz zur Ausschüttung von Insulins aus der β-Zelle ist der Blutzuckerspiegel (ab 5 mmol
Glucose/l
Blut), und dieser wird direkt von der β-Zelle „gemessen“. Biochemisch
umgesetzt wird das mit Hilfe von ATP-gesteuerten Kaliumkanälen, etc.,
siehe
#Glukosegesteuerter Freisetzungsmechanismus.
Die Hormone
Gastrin,
Sekretin,
GIP und
GLP-1 modifizieren den grundlegenden Glukose-Insulin-Regelkreis indem sie auf die β-Zelle wirken. Siehe
Inkretin-Effekt.
GIP wird von
K-Zellen, welche sich in der Schleimhaut des
Duodenums befinden und die Glukose im
Chymus
„messen“, ins Blut sezerniert und erhöht die Insulinausschüttung der
β-Zellen. Das GIP wirkt also auf die β-Zellen zu einem Zeitpunkt ein, wo
die Glukose aus der Nahrung noch nicht ins Blut gelangt ist.
GLP-1 wird von
L-Zellen, welche sich in der Schleimhaut des
Ileum und des
Caecum
befinden und die Glukose im Chymus „messen“, ins Blut sezerniert und
erhöht ebenfalls die Insulinausschüttung der β-Zellen. Der Großteil der
Nährstoffe wird bereits im
Jejunum
extrahiert und ins Blut bzw. in die Lymphe abgegeben. Im Caecum findet
keinerlei Absorption von Nährstoffen, sondern hauptsächlich eine
Fermentation statt.
Zusätzlich sind β-Zellen sowohl vom
parasympathischen als auch
sympathische Nervensystem innerviert:
Das parasympathische NS wird bei Leptin-Insuffizienz (oder auch bei
Leptin-Resistenz) aktiviert und wirkt allgemein trophotropisch, d. h.,
es bewirkt die Speicherung von Energie. Es erhöht also die
Insulinabgabe. Zumindest bei Mäusen wirkt es außerdem gleichzeitig auf
Adipozyten ein und erhöht ihre Empfindlichkeit für Insulin, während die
Empfindlichkeit der Leber- und Muskelzellen nicht beeinflusst wird.
Glukose wird in Leber- und Muskelzellen zu Glykogen verbaut und derart
gespeichert, in den Adipozyten erfolgt De-novo-Lipogenese und
Speicherung von TGs.
Das sympathische NS wird bei Leptin-Suffizienz aktiviert und wirkt
allgemein ergotropisch, d. h., es bewirkt die Erhöhung des
Energieverbrauchs. Es senkt die Insulinabgabe. Die Senkung der
Insulinabgabe scheint einem erhöhten Energieverbrauch entgegenzuwirken,
denn die Muskelzellen können sehr viel mehr Glukose aus dem Blut
aufnehmen, wenn sie möglichst viele GLUT-4 Transporter auf der
Oberfläche aufweisen. Sie müssen also auf die bereits gespeicherte
Energie in Form von Glykogen und Fettsäuren zurückgreifen.
Glukosegesteuerter Freisetzungsmechanismus
Im Bild die Schwankungen des Blutzuckers (rot) und das den Blutzucker kontrollierende
Hormons Insulin (blau) beim
Menschen über den Tagesablauf mit drei
Mahlzeiten. Aufgezeigt auch ist der Einfluss einer
zuckerhaltigen (gestrichelt) gegenüber einer
stärkehaltigen (durchgezogene Linie) Mahlzeit.
[15]
Ablauf der glukosegesteuerten Insulinfreisetzung
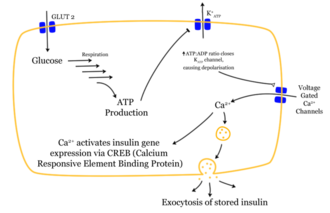
Das Eindringen eines Glukose-Moleküls in die β-Zelle setzt eine Wirkungskette in Gang. Nachdem die Glukose durch den
GLUT1-Transporter in die Zelle gelangt ist, wird sie durch
Glykolyse verstoffwechselt. Das dabei entstehende
ATP hemmt den Ausstrom von
Kalium-Ionen (
ATP-sensitive Kaliumkanäle). So kommt es durch den stark verminderten Kaliumausstrom zur
Depolarisation, weil die Stabilität des
Membranpotentials nicht weiter durch Kaliumausstrom erhalten wird. Das depolarisierte Membranpotential bewirkt eine Öffnung
spannungsabhängiger Kalzium-Kanäle. Der Einstrom der Kalziumionen ist der entscheidende Reiz für die Verschmelzung der insulinhaltigen
Vesikel mit der Zellmembran.
Die gespeicherten Insulinmoleküle werden durch Verschmelzen der Membranen (
Exozytose) aus den β-Zellen in den
Extrazellularraum
und weiter in den Blutkreislauf freigesetzt. Dabei werden die
Speicher-Hexamere aufgetrennt. Der Insulinspiegel im Blut steigt an.
Halbwertszeit und Abbau
Die
biologische Halbwertszeit einzelner Insulinmoleküle im Blutkreislauf liegt bei circa fünf Minuten.
[12]
Das Insulin wird über manche Insulinrezeptoren in die Zellen
aufgenommen, dort abgebaut und somit verbraucht. In der Leber und in der
Niere wird Insulin durch
Insulinase inaktiviert, die Insulinase oder genauer
Glutathion-Insulin-Transhydrogenase spaltet die Disulfidbrücken zwischen der A- und der B-
Kette auf, wodurch das Insulin in zwei Teile zerfällt und wirkungslos wird.
[16] Die Abbauprodukte werden durch die Niere ausgeschieden, ebenso 1,5 % des noch intakten Insulins.
[17] Die kurze Zeitspanne der Aktivität des Insulins zeigt, dass die
physiologische Steuerung des
Zuckerstoffwechsels im gesunden Körper sehr schnell funktioniert; diese
Geschwindigkeit kann bei der Behandlung des
Diabetes mellitus praktisch nicht erreicht werden.
Insulin als Arzneistoff
Wirkungsprofil verschiedener Insulinpräparationen bzw. Insulin
analoga nach subkutaner Injektion
In der
Insulintherapie werden verschiedene
Insulinpräparate verwendet. Die häufigste und älteste Verabreichungsart ist die
subkutane Injektion. Für diesen Zweck steht eine Reihe von kurz-, mittel- und langwirkenden Humaninsulinen und
Insulinanaloga zur Verfügung. Werden diese zur Therapie kombiniert, so ist auf die unterschiedliche
Halbwertzeit besonders zu achten.
- sehr schnell und kurz wirkend: Insulin glulisin, Insulin lispro, Insulin aspart
- kurz wirkend: Normalinsulin (= gelöstes Humaninsulin)
- intermediär wirkend: NPH-Insulin, biphasisches Insulin lispro, biphasisches Insulin aspart
- lang wirkend: Insulin detemir, Insulin glargin, Insulin degludec
Peroral ist Insulin unwirksam, da die Eiweißketten im
Magen-Darm-Trakt von körpereigenen
Enzymen abgebaut werden, bevor sie ihre Wirkung entfalten können. Untersucht wird, inwieweit sich Insuline in
Nanopartikel verkapseln lassen, um auf diesem Wege „unverdaut“ in den Blutkreislauf eingeschleust werden zu können.
[18] Jüngere Entwicklungen wie Präparate zur
Inhalation, die das Insulin über die Atemwege zuführen, haben sich auf dem Markt bisher nicht durchsetzen können.
In der Vergangenheit wurde Insulin im Rahmen der
Insulinschocktherapie zur Behandlung von Menschen mit
psychischen Krankheiten eingesetzt. Diese Methode der Behandlung wurde zum Beispiel im biografischen Film
A Beautiful Mind an
John Nash praktiziert. Dieses Verfahren wird nicht mehr praktiziert.
Missbrauch von Insulin
Insulin steht auf der
Liste der verbotenen Doping-Substanzen,
[19] da es zu mehreren Zwecken missbraucht werden kann. Da Insulin der durch
Somatropin
verringerten Glukoseaufnahme in die Muskelzellen entgegenwirkt, wird es
oft zur Kompensation dessen unerwünschter Nebenwirkung verwendet (siehe
Anabolikum). Andere Anwendungen sind die Förderung der Füllung der
Glykogenspeicher bei
Ausdauersportlern und die Unterstützung des Aufbaus von Muskelmasse.
[20]
Die
missbräuchliche Selbstverabreichung von Insulin, um den Blutzuckerspiegel übermäßig abzusenken, führt zum Krankheitsbild der
Hypoglycaemia f
actitia.
Im März 2008 wurde der
Krankenpfleger Colin Norris in Newcastle zu einer
Freiheitsstrafe von 30 Jahren verurteilt, weil er vier seiner Patientinnen durch Injektion zu hoher Insulindosen ermordet hatte.
[21]
...
Der Muskel
allgemeine Informationen für Kollegen
Synonym
Definition
- "Die Muskeln sind Organe, die die Fähigkeit besitzen, sich kontrahieren zu können… Sie leisten also mechanische Arbeit." (Herwig Hahn von Dorsche 1985)
- bauchiges Organ mit Ursprung und Ansatz, welches durch die
Abfolge von Kontraktion und Erschlaffen innere und äußere Strukturen des
Organismus (Gliedmaße, Rumpf, Kopf, Anhangsgebilde, Körperöffnungen,
Körperhöhlen, Organe, Gefäße) nähern bzw. bewegen kann
- Grundlage der aktiven Fortbewegung, der Gestaltveränderung, der
Kommunikation, vieler innerer Körperfunktionen, Blutzirkulation,
Wärmebildung, (Quelle: Wikipedia)
- als System (ca. 640 Muskeln von 1mm bis 40 cm Länge und
unterschiedlicher Dicke bzw. Breite) bis zu 40% des Körpergewichtes
eines Erwachsenen (zur Geburt ca. 20%, je nach Krafttraining bis zu 65%)
- durch Teile des Gehirns (Cortex) bewusst, aber auch durch
andere Teile wie Kleinhirn, Basalganglien und Vegetativum aber auch
Rückenmark autonom (ohne Willen) innerviert bzw. gesteuert (Dauer, Länge
und Frequenz der Kontraktion(en), Spannung bzw. Tonus, Reflexe)
- Namensgebung je nach Topographie, Form, Größe, Fiederung und Funktion
Embryologie
- aus Endoderm Entwicklung von Zellen, welche kontraktile Proteine
(Aktin, Myosin, u.a.) produzieren (Myoblasten), sich einzeln oder in
Verbänden (Synzytien) nach elektrischer Erregung (Aktionspotentiale)
verkürzen (Myozyten) und dann spezifizieren
- bei Skelettmuskel aus segmentiertem und unsegmentiertem
Mesoderm (Somatopleura) Differenzierung von Myotomzellen und dann
Verschmelzung dieser Myoblasten über Myotuben zu Myozyten mit mehreren
Zellkernen
- hier ab 8. Woche Bildung erster Myofibrillen
- ab 3. Monat erste Querstreifung aufgrund Anordnung der o.g. Filamente Aktin, Myosin usw. sichtbar
- nun Bündelung zu Fasern
- ab 5. Monat am Rumpf dorsale Anlage als Epimer und
ventrolaterale Anlage als Hypomer gegliedert (immer an Spinalnerv
orientiert)
- aus Epimer dorsale Muskeln, aus Hypomer ventrolaterale und
Extremitätenmuskulatur (hier schon ab 7. Woche Knospenbildung zu
erkennen)
- erst tiefe und proximale dann oberflächige und distale Muskeln entwickelt (Wancura-Kampik 2010)
- Kopfmuskeln folgen dem z.T. unsegmentierten Mesoderm (kraniale
Somiten, Kopfmesenchym und Kiemenbögen) und werden von Nn.
occulomotorius, trochlearis, trigeminus, abducens, facialis,
glossopharyngeus, azzessorius und hypoglossus "verfolgt"
- ab Geburt keine Neubildung mehr, nur noch Volumenzunahme
Arten
Glatte bzw. Viszeralmuskulatur
- einzelner spindelförmiger Myozyt mit Kern, Plasma, kontraktilen
Filamenten (Aktin und Myosin) und Membran, untereinander Nexus,
innerviert durch vegetative Nervenendigungen, ständig aktiv

|
|
glatte Muskelzellen (mikroskopisches Präparat 400fach vergrößert,
Institut für Anatomie der Ernst-Moritz-Arndt Universität zu Greifswald,
nachgezeichnet 5.1.1988)
|
Herzmuskulatur
Quergestreifte bzw. Skelettmuskulatur
- Faser als Synzytium mehrerer Myozyten mit Filamenten (Aktin und Myosin), welche charakteristische Querstreifung bzw. Cohnheim-Felderung
hervorbringen, mehreren randständigen Kernen und Satellitenzellen sowie
transversalen und longitudinalen Tubuli, innerviert durch einzelne
Nerven (Alpha- und Gamma-Fasern) über motorische Endplatte, enthält
diverse "Kontrollorgane" wie Muskelspindel usw., unterschiedliche
Energiespeicher (u.a. Myoglobin) bzw. Fasertypen und damit ermüdbar,

|
|
quergestreifte Muskulatur (mikroskopisches Präparat 400fach
vergrößert ,Institut für Anatomie der Ernst-Moritz-Arndt Universität zu
Greifswald, nachgezeichnet 5.1.1988)
|
Anatomie des Skelettmuskels
- tiefdunkelrote Farbe
- bei Kontraktion hart, dicker und verkürzt, bei Erschlaffung weich, schmaler und länger
- jeder Muskel hat Bauch (venter ), Ursprung (origo ) meist als punctum fixum proximal und Ansatz (insertio ) meist als punctum mobile distal innerhalb einer Faszie (fascia ) bzw. bindegewebigen Hülle
- mit jeweiligem Übergang zu Sehne (tendo ) einschl. Peritenium (ggf. sogar eingelagertem Sesambein), Kapsel (teilweise sogar intraartikuläre Muskelfasern) und Periost (Sehne, Faszie und Kapsel)
- Eintritt eines Gefäß-Nervenbündels am Hilus (Verlauf dann innerhalb bindegewebiger Faszie und Septen)
- Muskeln haben unterschiedliche Bauchformen, zeigen in der
Anordnung ihrer Fasern zur Längs-, Querachse und zum Verlauf der Sehnen
unterschiedlicher Fiederungen und kann man je nach Topographie (befinden
sich an Gliedmaßen oft gemeinsam in so genannten Muskellogen) und
Funktion (Syn- bzw. Agonisten als Helfer und Antagonisten als
Gegenspieler) unterteilen (Herwig Hahn von Dorsche 1985, Müller-Wohlfahrt et al. 2010 )
Formen
- gerade (M. rectus)
- platt (M. planus), meist Sehnenplatte (Aponeurose)
- spindelförmig (M. fusiforme), ein-, zwei- (M. biceps bei
parallel liegenden Bäuchen, biventer sive digastricus bei hintereinander
liegenden Bäuchen), drei- (M. tricpes), vier- (M. quadricpes) oder
mehrköpfig , meist parallele Fasern, Bewegungsmuskel
- quadratförmig (M. quadratus)
- dreieckig (M. triangularis)
- ringförmig (M. orbicularis)
Fiederung
- einseitig (M. unipennatus), meist kurze Fasern zwischen Sehnen, meist Haltemuskeln
- beidseitig (M. bipennatus)
- mehrfach (M. multipennatus) mit größerem physiologischen Querschnitt und damit Kraftentwicklung
Funktion
- Beuger (M. flexor)
- Strecker (M. extensor)
- Anzieher (M. adductor)
- Abzieher (M. abductor)
- Schließer (M. sphincter)
- Erweiterer (M. dilatator)
- Heber (M. elevator)
- Spanner (M. tensor)

|
|
(Quelle: Wikipedia)
|
Histologie
- Muskelbauch mit primärem, sekundärem und tertiärem Bündel aus Fasern (<1 mm - >30 cm Länge)
- wiederum aus zahlreichen Fibrillen (ca. 1µm dicker "Schlauch")
mit Filamenten Aktin (5 nm dick), Myosin (10 nm dick) und anderen
Einweißen wie Troponin bzw. Tropomyosin (Sarkomer=kleinste Einheit)
- dazu Hülle (Faszie) und Septen (Endo-, Perimysium internum und externum sowie Epimysium),

|
|
aus Despopoulos A, Silbernagl S (1986)
|
- Zelle mit Membran bzw. Sarkolemm, mehreren randständigen Kernen
(pro mm 50-100), Sarko- bzw. Zytoplasma mit Zytoskelett, Mitochondrien
und endo- bzw. sarkoplasmatischem Retikulum bzw. transversale und
longitudinale Tubuli
- Sarkolemm ist semipermeabel, wichtig für Regeneration, enthält
Kollagen Typ IV, Fibronektin und Laminin sowie Poren, Kanäle und
Rezeptoren für Verbindung zwischen endo- bzw. sarkoplasmatischem
Retikulum (enthält Calsequestrin, dem Calcium-Speicher) und Matrix über
transversale und longitudinale Tubuli (sakrotubuläres System)
- Mitochondrien (variable Zahl pro Faser bzw. Zelle, wobei bei
Typ 1 und Sportlern mehr) unterhalb Membran bzw. I-Band, reich an
Fermenten der Atmungskette, Fettsäuren, Carnithin, Cytochromoxidasen,
- Plasma enthält Speicher (Schollen, Vakuolen, Tröpfchen bzw.
Lysosomen) für Energiestoffwechsel und zahlreiche Intermediärfilamente
wie Troponin, Tropomyosin, Myoglobin und Aldolase im I-Band, Titin und
F-Protein im A-Band, MM-Kinase im M-Band, Desmin und Vimentin im Z-Band,
usw.
- Ribosomen in Nähe der motorischen Endplatte
- in einer Faser nicht nur mehrere Fibrillen, sondern pro
Fibrille mehrere Filamente (jeweils ca. 2000 Aktin-Fäden und ca. 1000
Myosin-Bündel), welche Sarkomer mit Z-Scheibe als Verbindung zueinander
bilden (pro Gramm Muskel 100mg kontraktile Proteine mit ca. 70% Myosin,
eine ATPase (500000 Dalton) aus 2 schweren und 4 leichten umeinander
gewickelte Ketten und Köpfchen, und 30% Aktin mit G-Aktin als Monomer
von 42000 Dalton zu F-Aktin, den Fäden), daraus ergibt sie Querstreifung
(innerhalb Z: A-Band (Länge von Myosin-Bündel), innerhalb A: H-Band
(Differenz der von beiden Seiten des Myosin "herangezogene" Aktin) sowie
jeweils ½ I-Band als "myosinfreie" Reserve am Rande vom Sarkomer)
- innerhalb bzw. parallele zu Faser im perifaszikulären BG
Muskelspindel (wenige mm lang und 250µm dick) mit Kapsel, welche über
sensible Ia- und II-Afferenzen sowie tonische und phasische Alpha-,
Beta- und Gamma-Efferenzen intrafusale Fasern (Nuclear-bag- und
Nuclear-chain-Fasern) und damit Muskeltonus reguliert
- ein oder mehrere periphere Nerven bilden u.a. über Alpha-Fasern
eine motorische Endplatte pro Muskelfaser, Efferenzen von
Golgi-Apparaten des Sehnenüberganges zum ZNS und als vegetative und
andere C-Fasern von BG und Gefäßen zum Sympathikus, Endplatte selbst aus
Schwann-Zellfortsatz mit Einbuchtungen, Membran, Vesikeln für Calcium und Rezeptoren für Acetylcholin (Der Nerv),
- Synapse immer gleich stark (ca. 300 Ä) da muskulär auch
Faltenapparat, hier grenzt sarkoplasmatisches System und Mitochondrien
an,

|
|
aus Despopoulos A, Silbernagl S (1986)
|
Physiologie
Erregung
- durch zentrales Nervensystem über Cortex (und durch Mittel-,
Zwischen- und Stamm- sowie Kleinhirn beeinflusst) zu Rückenmark mit
Alpha-Motoneuron bis peripherer Nerv (mit Markscheide und Axon) und
seinem Neurit (bis > 1m) Impuls (60-120ms)
- ja nach Muskel von 4 bis >1000 Muskelzellen pro Motoneuron erregt
- an motorischer Endplatte bzw. Synapse Weiterleitung Impuls
durch Transmitter (von prä- auf postsynaptische Membran bzw. Sarkolemm
mit Rezeptor) und entsprechende biochemische Auslösung einer Kontraktion
(u.a. Freisetzung von Kalzium in Zisternen, Triaden oder auch T-System
des sakrotubulären Systems)

|
|
aus Despopoulos A, Silbernagl S (1986)
|
Kontraktion
- Kalzium ermöglicht erst Ruderschlag, da durch intrazelluläres
Kalzium an Troponin, welches mit Tropomyosin spiralförmig um Aktin
gebunden ist, Bindung der Myosinköpfe an Aktin
- innerhalb kurzer Latenzzeit (wenige Millisekunden) Aktivierung
Myosin bzw. ATPase durch Magnesium und Kalzium, wodurch Wärmeenergie
frei wird, ATP von Myosinköpfen gelöst und diese abgewinkelt werden
- Aktinfilament (an Z-Bande befestigt) rutscht durch Ruderschlag aufeinander zu (Gleitfilamenttheorie)
- dadurch Annäherung der Z-Scheiben Verkürzung des Sarkomers bzw. Kontraktur der Fibrille bzw. Faser
- nach Phosphorylierung von ADP zu ATP (u.a. anaerob: pro
Kreatin(in)phosphat 1 ATP und pro Glycogen unter Verbrauch von 2 ATP und
Entstehung von 2 Laktat 4 ATP sowie aerob pro Zitratzyklus unter
Verbrauch von 6 O2 und Entstehung von 6 CO2 und H2O 34 ATP) Bindung an Myosinköpfe und Lösung von Aktin (Erschlaffung)
- ATP ermöglicht Lösung der Querbrücken für neuen Ruderschlag (vgl. Totenstarre)
- nun wieder Kalziumeinstrom unter Anwesenheit von Magnesium und
Phosphate (Myoglobinspeicher) bzw. "Blut" und Abtransport von Kreatinin,
Laktat, Kohlendioxid sowie Wasser
- pro motorische Endplatte bzw. Einheit entweder mehrere Salven
(von wiederholter Kontraktion über Haltearbeit bzw. Krampf) oder
Erschlaffung
- bei Kontraktion Ökonomisierung durch Rekrutierung nacheinander "eingeschalteter" Einheiten während Kontraktion ohne Krampf
- je nach Anforderung zentrales An- und Abschalten mit Synchronisation von max. 80-90% der Fasern bei Überforderung (Zittern)
- bei Erschlaffung und unauffälliger Anatomie Tonus als Ergebnis
einer Spannung aller Fasern (abhängig vom Sympathikus, Muskel- und
Sehnenspindel, kontraktile Proteine und Enzyme, Minerale und
Energiespeicher bzw. -stoffwechsel, großer Einfluss von ZNS (Kleinhirn,
Mittel- und Zwischenhirn, limbisches System, Cortex usw.))
- Tonusregulation auch durch Psyche und Extrapyramidales System
- bei Tonuserhöhung Rigor möglich (Das vegetative Nervensystem)
- bei Ermüdung auch Anstieg des Tonus (Hypertonus, Hyperfascillitation)
- im Tiefschlaf sowie Störung der o.g. Tonusfaktoren Herabsetzung des Tonus (Hypotonus, Hypofascillitation, Weekness) (applied kinesiology bzw. AK)
Energie
Muskel- bzw. Fasertypen
- langsam kontrahierende
(slow twitch bzw. ST) mit ca. 75ms, nahezu unerschöpfliche rötere
Fasern, sehr viele Mitochondrien, Myoglobin, Kapillaren, Fettspeicher,
Enzymen des aeroben KH-Stoffwechsels, aber wenig Kraft pro Kontraktion,
kleine Endplatten, wenig Phosphat und ATP-ase, hier aerobe
Phophorylierung zu ATP unter Verbrauch von O2 und Entstehung von CO2 sowie H2O
- schnell kontrahierende (fast twitsch bzw. FT) und sehr schnell ermüdbare weißere Fasern mit Unterscheidung in
-
oxidativ aerob bzw. FTO mit ca. 30ms, mäßig viele Mitochondrien,
Myoglobin, Kapillaren, Fettspeicher und Enzyme, wobei auch die des
anaeroben Stoffwechsels, aber viel KH gespeichert, hier anaerobe
Phophorylierung zu ATP aus Kreatin(in)phosphat und Glycogen unter
Verbrauch von zunächst ATP und schließlich Gewinnung von ATP unter
Entstehung von Laktat sowie auch aerobe Phosphorylierung (siehe
ST-Fasern)
-
glykolytisch anaerob bzw. FTG mit ca. 20ms (noch schneller ermüdbar),
aber sehr große Kraft pro Kontraktion, große Motoneurone und Endplatten,
wenig Mitochondrien, Myoglobin und Kapillaren, jedoch viele Phosphate,
ATP-ase, KH und Enzyme des anaeroben Stoffwechsels, hier nur anaerobe
Phophorylierung wie oben aus Kreatin(in)phosphat und Glycogen unter
Entstehung von Laktat
- Aufteilung genetisch festgelegt und nach Pubertät kaum veränderlich
- Übergang von Typ II zu I und umgekehrt quasi nicht mgl. (cave: Extrembedingungen)
- ST mehr bei Langstrecken- bzw. Ausdauersportler, und FT mehr bei Sprintern und Werfern, dazwischen Breitensportler
- Training (Schnelligkeit) von FTO zu FTG möglich
- Schonung einschl. Ruhigstellung im Gips o.ä. sowie
Schwerelosigkeit fördern Abnahme Querschnitt, Elastizität, Tonus, Kraft,
Kapillaren, Mitochondrien, Enzyme und Substrate
Regulation
Mechanik
- Kraft eines Muskels entspricht Summe aller Zug- bzw.
Kontraktionskräfte aller Fasern, also Querschnitt (nicht anatomisch,
sondern physiologisch, was durch schrägen Verlauf oder intramuskuläre
Sehnen und Septen verstärkt wird) mit bis zu 40N pro cm2
- Muskelkraft auch von Rekrutierung der Fasern und Frequenz des
AP abhängig (je nach Anforderung zentrales An- und Abschalten mit
Synchronisation von max. 80-90% der Fasern bei Überforderung mit
Zittern)
- bei (Vor)dehnung plastisch-elastische Verformung und
Optimierung der Kraftentwicklung (Ruhedehnungskurve), da parallel
geschaltete Elemente angespannt sind (ca. 2,2µm Sarkomer-Länge) und
Verschlechterung bei Überdehnung (ca. 3,6µm) und minimaler Länge
(<1,5µm)
- durch Dehnung seriell geschalteter Elemente isometrische
Kontraktion und schließlich nach Erreichen der notwendigen Kraft
isotonische Kontraktion (Unterstützungskontraktion) für Verrichten der
Arbeit möglich
- weitere Kontraktionsformen (konzentrisch (neben isotonisch
isokinetisch und auxotonisch), schließlich exzentrisch mit erhöhter
Wahrscheinlichkeit von "Muskelkater"
- je größer die Belastung, desto geringer die Verkürzung
- bei maximaler isometrischer Kontraktion Hypertrophie
- erhöhte Wärmeproduktion durch Erniedrigung der mechanischen
Arbeit bei Erhöhung der chemischen Energie (Erhöhung der AP bei
Tonuserhöhung und Tetanus) möglich (Muskelzittern bei Frieren und
Schüttelfrost)
- Verkürzungs- bzw. Kontraktionsgeschwindigkeit nach Hill in Ruhe bzw. ohne Last, dagegen Leistung ebenso wie Arbeit bei mittlerer Belastung am größten (Schmidt und Thews 1995)
Elektrik
Elektrik
- über elektrischen Reiz (Aktionspotential) erfolgt Einzelzuckung (vgl. Reflex nach Pawlow)
- erst durch mehrere Einzelzuckungen entsteht Kontraktionswelle
- willkürliche Aktion ergibt Summation von Kontraktionswellen
- Faser hat Refraktärzeit, in der die "neue" Kontraktion
vorbereitet wird und bei neuem Reiz innerhalb der Einzelzuckungszeit
eine Tetanie auftreten kann (jedoch fließender Übergang von
unvollständiger zu vollständiger Tetanie)
- bei externen Reizen (z.B. Elektrotherapie Elektrotherapie und Ultraschall) entspricht die Stromstärke, welche bei langer Einwirkungszeit gerade noch Kontraktion auslöst, der Rheobase und nach Titow die Zeit bis zur Kontraktion bei doppelter Rheobase Chronaxie (Badtke 1999)
- weitere Regulierung durch Rekrutierung von motorischen
Einheiten durch ZNS, so in Augenmuskeln pro Muskel zahlreiche motorische
Einheiten mit wenig Fasern pro Einheit (ca. 5) und geringer
Kraftentwicklung und in Extremitätenmuskeln umgekehrt (ca. 2000)
- Endpunkt Synchronisation von max. 80-90% der Fasern bei Überforderung (Zittern)
Chemie
- Kontraktionen erzeugen Wärme(energie), so Erhaltungswärme, initiale Wärme und Erholungswärme
- Unterschied bis zu 1000fach
- Wirkungsgrad unterschiedlich, da chemische Energie durch
Phosphorylierung von ADP zu ATP = Summer von mechanischer Energie und
Wärme
- effektiver bei kurzer mechanischer Leistung ohne Erholung in warmen Bedingungen und umgekehrt
- Sauerstoffverbrauch jedoch abhängig von Fasertyp und Leistungsaufgabe (bis zu 100fach beim Ausdauersport)
- Myoglobingehalt zuständig für Sauerstoffaufnahme bzw. -speicherung intrazellulär
- wenn viel Myoglobin (rote Muskeln mit Typ I-Fasern) zwar
langsamere Kontraktion, jedoch geringerer Ermüdbarkeit bei
ernergiesparendem oxidativen Stoffwechsel mit wenig ATP-ase und LDH
(z.B. Rumpfmuskulatur, M. soleus)
- wenn wenig Myoglobin (weiße Muskeln mit Typ II-Fasern) zwar
schnellere Kontraktion, jedoch schnellere Ermüdbarkeit bei aufwendigem
glykolytischen Stoffwechsel mit hoher ATP-ase und LDH (z.B. M. biceps
brachii)
- Energie-Lieferanten sind Kreatinphosphat, Glucose (welches
anaerob über Pyruvat zu Lactat oder aerob über Pyruvat zu Kohlendioxid
und Wasser abgebaut wird) und Triglyceride
- Ermüdung entspricht einer intrazellulären Acidose durch Metabolite und zeigt sich im erhöhten Tonus (Muskelverspannung bzw. Myogelose, Muskelschwäche bzw. Myopathie)
...
Wissenschaftliche Beschreibung
Myoglobin ist ein
Häm-basiertes,
globuläres, einkettiges
Protein aus 153
Aminosäuren mit einer
Molekülmasse von 17.053
Dalton (17 kDa), das die Fähigkeit besitzt,
Sauerstoff (O
2)
reversibel zu binden. Die
Sekundärstruktur des Proteins besteht aus insgesamt acht
α-Helices.
Unter physiologischen Bedingungen liegt es als
Monomer vor. Das aktive Zentrum des Myoglobins ist ein Häm
b, d. h. ein
Protoporphyrin IX mit einem über die vier inneren
Stickstoffe ligierten
Eisen(II)-Ion. Das Häm ist über ein
axial an das zentrale Eisenion koordiniertes, proximales
Histidin an die Proteinmatrix gebunden. Die zweite axiale Position dient der Bindung des Sauerstoffmoleküls.
Im Gegensatz zum strukturverwandten
Hämoglobin bindet Myoglobin den Sauerstoff nicht
positiv kooperativ, sondern unabhängig von der Sauerstoffkonzentration der Umgebung.
Das Vorkommen von Myoglobin ist auf
Herz- und
Skelettmuskelzellen von
Säugetieren
beschränkt. Hier liegt es in hohen Konzentrationen (bis etwa 100
µmol/l) vor und gibt dem Muskelgewebe seine rote Farbe. Die
Sauerstoffaufnahme kann gut
absorptionsspektroskopisch verfolgt werden, die charakteristische
Soret-Bande des Häm verschiebt sich bei Sauerstoffaufnahme deutlich von 418 zu 434 nm.
Myoglobin zählt zu den
Globinen. Dem Myoglobin nah verwandt ist das erst 2002 beschriebene
Cytoglobin,
[1]
welches in nahezu allen Zellen der Wirbeltiere vorkommt. Es dient
vermutlich ebenso als Sauerstoffspeicher in der Zelle. Es scheint sogar,
dass Myoglobin wohl während der
Evolution durch eine
Genduplikation die muskelspezifische Variante des Cytoglobins geworden ist.
Bedeutung
Als
biologische Funktion wird der Sauerstoff-Transport innerhalb der
Zelle, von der
Zellmembran zu den
Mitochondrien,
angesehen. Aus diesem Grund ist seine Affinität zum Sauerstoff auch
höher als bei Hämoglobin, dies fördert den Sauerstofftransport in
Richtung Zellinneres. Auch die beim Hämoglobin beobachtete Regulation
der Sauerstoffaffinität fehlt dem Myoglobin. Zumindest bei
Meeressäugetieren wird auch die Sauerstoff-Speicherung diskutiert:
Wale haben einen etwa 5- bis 10-mal höheren Myoglobin-Gehalt in ihrer Muskulatur als
Landsäugetiere.
Beim Menschen enthalten die Muskeln etwa 6 Gramm Myoglobin pro
Kilogramm, beim Seehund sind es 52, beim Pottwal sogar 56 Gramm. Dort
dient es den Meeressäugern beim Tauchen als Sauerstoffvorrat.
[2]
Das Myoglobin des
Pottwals war daher auch das erste Protein, an dem
John Kendrew 1958 eine Strukturaufklärung (
Röntgenstrukturanalyse) gelang.
[3] Diese Pionierleistung war Grundlage für die spätere Aufklärung der Hämoglobin-Struktur durch
Max Perutz (
1959).
[4] Beide Wissenschaftler erhielten
1962 den
Nobelpreis für Chemie.
Bedeutung in der Medizin
Ein Anstieg der Myoglobinkonzentration im
Blutserum von Säugetieren kann aufgrund von
Rhabdomyolyse als Indikator für einen
Herzinfarkt gelten. Da ein erhöhter Myoglobinwert aber unspezifisch ist, verwendet man heute die
Creatinkinase zur Herzdiagnostik. Weiterhin zeigen sich erhöhte Myoglobinwerte bei Schädigung der Skelettmuskulatur (extremer Sport,
epileptische Anfälle,
Polytrauma,
intramuskuläre Injektionen,
Alkoholintoxikation,
Muskelerkrankungen, Verschüttungen (z. B. bei Erdbeben)); diese können
bei extrem erhöhten Werten zu einem akuten Nierenversagen führen (
Crush-Niere).
[5][6]
Die Plasmahalbwertszeit von Myoglobin beträgt nur 10 bis 20 min, da es rasch über die
Nieren
ausgeschieden wird (glomeruläre Filtration). Der Myoglobinwert steigt
bei einem Herzinfarkt nach ca. 1–2 Stunden an und erreicht sein Maximum
nach 4–6 Stunden. Bereits innerhalb von 12–24 Stunden sinkt es wieder in
den Normbereich ab.
Normwerte beim Menschen im
Blut:
[7] Frauen bis 35 µg/l, Männer bis 55 µg/l
Normwert beim Menschen im
Urin: Frauen und Männer bis 0,3 mg/l