Müsst Ihr nicht verstehen .. aber bin für jeden Tipp dankbar
Ich stelle hier mal für mich zwei Links und Texte rein ... der erste über Insulin, wo aber nichts dabei steht, wie genau das mit den Myoglobinspeichern in der Muskulatur zusammenhängt.
Der zwetei über die Funktionsweise der Muskeln, wo ganz unten was drüber steht, wie eine Myopathie ehtsteht.
Der dritte über Myoglobin. Myoglobin transportiert nicht Glucose, speichert auch keine Glucose, sondern Sauerstoff .. dritter Link ist einer darüber, was Myoglobin eigentlich tut.
Bin noch vollkommen ratlos, wie das zusammenhängt, möchte diese drei Sachen hier nur mal zusammen reinstellen, damit ich das, sollte mein Hirn mir da später mal weiterhelfen, die Lösung zu entdecken, dann zusammenhängend wiederfinde.
Siehe unten:
LG Renate
nsulin (andere Namen: Insulinum, Insulinhormon, Inselhormon) ist ein für alle Wirbeltiere lebenswichtiges Proteohormon (Polypetidhormon), das in den β-Zellen der Bauchspeicheldrüse gebildet wird. Diese spezialisierten Zellen befinden sich nur in den Langerhans-Inseln. Von diesen Inseln leitet sich auch der Name „Insulin“ ab (lateinisch insula). Insulin senkt den Blutzuckerspiegel, indem es andere Körperzellen dazu anregt, Glukose aus dem Blut aufzunehmen.
Inhaltsverzeichnis
Funktion und Wirkung
Die Regulation der Konzentration von Glukose im Blut erfolgt durch einen Regelkreis aus zwei Hormonen, die abhängig von der Blutzuckerkonzentration ausgeschüttet werden. Insulin ist das einzige Hormon, das den Blutzuckerspiegel senken kann. Sein Gegenspieler ist das Glucagon, dessen Hauptaufgabe es ist, den Blutzuckerspiegel zu erhöhen. Auch Adrenalin, Kortisol und Schilddrüsenhormone haben blutzuckersteigernde Wirkungen.Der Blutzuckerspiegel steigt vor allem nach der Aufnahme von kohlenhydratreicher Nahrung. Als Reaktion darauf wird von den β-Zellen Insulin ins Blut ausgeschüttet. Insulin senkt den Blutzuckerspiegel dadurch, dass es mittels seiner „Schlüsselfunktion“ der Glukose aus dem Blutplasma und der Gewebsflüssigkeit den Durchtritt durch die Zellmembran in das Zellinnere ermöglicht. Vor allem die Leber- und Muskelzellen können in kurzer Zeit große Mengen Glukose aufnehmen und sie in Form von Glykogen speichern oder in Energie umwandeln (siehe Glykolyse).
Auch auf andere Zellen wirkt das Hormon, so hat es Einfluss auf den Fett- und Aminosäurestoffwechsel sowie auf den Kaliumhaushalt.
Das Hormon ist wesentlicher Faktor folgender Erkrankungen:
Insulinmolekül
Animation der Tertiärstruktur von Insulin
Insulinrezeptor
Letztlich löst die Bindung dieses Hormons an seinen Rezeptor eine Reihe von Kinase-Kaskaden (Kaskade von Phosphorylierungsreaktionen) aus, die durch Signalwege beschrieben werden können.[2]Diese Signalwege bewirken ein Sinken des Blutglucosespiegels durch
- Förderung der Glucose-Aufnahme (GLUT4-Translokation zur Zelloberfläche)
- Förderung der Glucose-Speicherung (Glykogensynthese) in der Leber und den Muskeln
Glukoseaufnahme im Muskelgewebe
Das Hormon erhöht in der Muskulatur und im Fettgewebe die Permeabilität (Durchlässigkeit) der Zellmembran für Glucose. Dabei ist zu beachten, dass nicht die Membran selbst permeabler wird, sondern dass vermehrt Carrier-Proteine für Glucose aktiviert werden. Dieses Carrier-Protein ist GLUT4, ein hochaffiner, insulinabhängiger Glucose-Transporter, welcher die Glucose durch erleichterte Diffusion (passiver Transport) in die Zelle transportiert. Folgende physikalische Eigenschaften sind für GLUT4 relevant: sättigbar, nicht aktivierbar oder inaktivierbar, also Regulation nur durch insulinabhängigen Einbau oder Ausbau.Glukoseaufnahme und Stoffwechsel im Gehirn
Nervenzellen (und Erythrozyten) nehmen Glucose insulinunabhängig auf. Deshalb nehmen die insulinabhängigen Zellen bei einem erhöhten Insulinspiegel mehr Glucose auf, und für die insulinunabhängigen bleibt weniger übrig.Im Allgemeinen besteht bei Hypoglykämie die Gefahr, dass das auf Glucose angewiesene Nervensystem geschädigt wird. Beachtenswert ist der Effekt, dass Insulin, verabreicht als Nasenspray in direktem Kontakt mit dem ZNS, die Alzheimer-Krankheit positiv beeinflusst.[3]
Auf- und Abbau von Fettgewebe
Das Hormon hemmt die Lipolyse im Fettgewebe und somit den Abbau von Fett. Ein Insulinmangel führt daher zu einer gesteigerten Lipolyse mit Bildung von Ketokörpern und einer daraus resultierenden Ketose.Förderung des Zellwachstums
Eine weitere zentrale Funktion des Peptidhormons Insulin besteht in der Regulation von Zellwachstum und Proliferation durch die Aktivierung der Transkription von Genen, die für Kontrolle und Ablauf des Zellzyklus von großer Bedeutung sind. Diese Insulinwirkung ist bei Diskursen über Insulinpräparate ein Thema.Tryptophan-Aufnahme im Gehirn
Höhere Insulinspiegel haben einen leicht steigernden Einfluss auf die Aufnahme von Tryptophan ins Gehirn.[4]Insulin und die Regelung des Blutzuckerspiegels
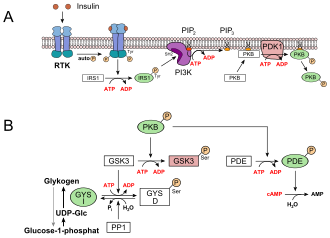
Vereinfachte Darstellung der Signalkaskade für Insulin zum Aufbau von Glykogen (Einzelheiten im Text)
- In der Leber und der Muskulatur werden die mit der Nahrung aufgenommenen Kohlenhydrate als Glykogen gespeichert. Dies hat ein Absinken der Glucosekonzentration im Blut zur Folge. Die Glucoseaufnahme in die Leberzellen erfolgt insulinunabhängig über GLUT2. Durch Insulin wird eine Rezeptor-Tyrosinkinase (RTK) aktiviert, die eine Signaltransduktion in Gang setzt. Beteiligt sind dabei das Insulinrezeptorsubstrat 1 (IRS1), die Phosphoinositid-3-Kinase (PI3K), der second messenger Phosphatidylinositol-4,5-bisphosphat (PIP2), die Phosphoinositid-abhängige Kinase-1 (PDK1) und schließlich die Proteinkinase B (PKB) (siehe Bild, A). PKB phosphoryliert die Glykogensynthase-Kinase 3, GSK3, die dadurch inaktiviert wird. GSK3 ist eine Kinase, die die Glykogensynthase phosphoryliert und damit inaktiviert (GYS b). GSK3 steht in Konkurrenz zu einer Phosphatase, der Protein-Phosphatase 1 (PP1). Dadurch, dass GSK3 nicht mehr wirken kann, liegt daher immer mehr Glykogensynthase in seiner dephosphorylierten Form vor (GYS a, siehe unteres Bild, B). Außerdem aktiviert die PKB eine Phosphodiesterase, PDE, die cAMP zu AMP hydrolysiert. Infolgedessen erlischt zusätzlich der Signalweg für die Proteinkinase A, die für den Abbau von Glykogen sorgt.
- In der Leber, dem Fettgewebe und der Muskulatur wird unter Insulineinfluss die Triglyceridsynthese stimuliert. Substrate dafür sind neben den Kohlenhydraten mit der Nahrung aufgenommene Lipide.
- In den drei genannten Geweben werden Aminosäuren verstärkt aufgenommen und für die Proteinsynthese verwendet.
- Insulin induziert weiterhin die Glykogensynthese und -speicherung in Leber und Muskel, die Triglyceridsynthese in Leber und Fettgewebe sowie die Speicherung von Aminosäuren im Muskel.
- Gleichzeitig hemmt Insulin die hepatische Gluconeogenese und zählt daher insgesamt zu den wichtigsten Regulatoren des Glucosemetabolismus.
Gegenspieler
Fällt der Blutzuckerspiegel im Körper unter einen Wert von 80 mg/dl ab, wird die Insulinproduktion bereits stark reduziert.Sinkt der Blutzucker weiter ab, treten verschiedene Gegenspieler des Insulins auf:
Die Spiegel dieser gegenregulierenden Hormone steigen bereits deutlich an, wenn der Blutzucker unter 60 mg/dl absinkt.
Beim Typ 1-Diabetes ist oft auch der Gegenregulationmechanismus gestört, was zu zusätzlichen Problemen mit Hypoglykämien führt.
Somatostatin hat einen hemmenden Einfluss auf die Sekretion von Insulin und Glucagon, da er als allgemeiner Hemmer im Körper fungiert.
Vorkommen
Insulinsequenzen von mehr als 100 verschiedenen Spezies sind bekannt. Die Proteinsequenzen der jeweiligen Insuline sind sich ähnlich – sie zeigen Sequenzhomologie – sind aber nicht identisch.[5] Über die Unterschiede im chemischen Aufbau von Humaninsulin gegenüber den Insulinen einiger Säugetiere sowie Informationen zu künstlich hergestelltem Insulin siehe Insulinpräparat.Insulin und Evolution: Genotypen, die in Jäger- und Sammlergesellschaften einen raschen Abbau von Energiereserven bei Nahrungsmangel verhinderten, prädisponieren beim heutigen Lebensstil mit Bewegungsmangel und Nahrungsüberangebot zu Adipositas und Typ-2-Diabetes.[6]
Inwieweit Gene den Glukosestoffwechsel und die damit verbundene Wirkung von Insulin beeinflussen, ist noch nicht zur Gänze geklärt.[7]
Bildung, Speicherung, Freisetzung und Regulierung
Biosynthese
Die Synthese des Hormons erfolgt in den β-Zellen der Langerhansschen Inseln der Bauchspeicheldrüse. Die genetische Information wird von nur einem Genlocus im kurzen Arm des Chromosom 11 codiert. Das Gen besteht aus ungefähr 300 Nukleotiden.[8][9]Die mRNA wird zunächst an Ribosomen, die sich auf dem rauen endoplasmatischen Retikulum (ER) befinden, in das Präproinsulin translatiert, das aus 110 Aminosäuren besteht.
Die weitere Prozessierung erfolgt in zwei Schritten, nach der Faltung des Moleküls durch Bildung von Disulfidbrücken entsteht durch Abspaltung von Signalpeptid und C-Peptid das Insulinmolekül.
1) Die Abbildung zeigt das Präproinsulin-Molekül[10] mit 110 Aminosäuren, bestehend aus:
4) Abspaltung von Signalpeptid und C-Peptid:
|
Prozessierung des Präproinsulin zum Insulin
Schematische Darstellung (Topologiemodell) von Proinsulin (B-Kette
orange, A-Kette grün, C-Peptid grau). Das C-Peptid wird
herausgeschnitten. Das Signalpeptid des Präproinsulins ist nicht
dargestellt.
|
Speicherung
Hexamer aus Insulinmolekülen
Die hohe Bindungsfreudigkeit von Insulinmolekülen an Zink hat mehrere wichtige Auswirkungen. Insulin ist in der Form von Hexameren und nach dem Zerfall in Dimere noch nicht wirksam, sondern nur als Einzelmolekül. Diese Eigenschaft spielt bei den Insulinpräparaten eine wichtige Rolle. Bei schnellwirkenden Insulinpräparaten ist der zu langsame Zerfall der Molekülverbände unerwünscht und es wird nach Möglichkeiten gesucht den Zerfall zu beschleunigen. Bei langwirkenden Insulinpräparaten wird die Zinkbindung zur Verlängerung der Wirkdauer durch hohe Zinkkonzentrationen gezielt verstärkt. Bei der Entwicklung von oralen Insulinpräparaten wird die Zinkbindung zur Kopplung von Insulin an Transportmoleküle genutzt.
Ausschüttung
Oszillierende Insulinausschüttung
Spiegel von Insulin, Glucagon und GLP-1 nach einer Mahlzeit bei Stoffwechselgesunden. Der Blutzuckerverlauf entspricht etwa der Kurve von GLP-1.
Die Insulinausschüttung erfolgt oszillierend. Alle drei bis sechs Minuten wird Insulin in die Blutbahn abgegeben. Nach der Nahrungsaufnahme ist bei Stoffwechselgesunden ein biphasischer Verlauf der Insulinsekretion feststellbar: Der erste „Insulinpeak“ hat seine Spitze nach drei bis fünf Minuten und dauert zehn Minuten. Danach schließt sich eine zweite Phase an, die so lange anhält, wie eine Hyperglykämie besteht.[12] Die erste Phase besteht aus den gespeicherten Insulinmolekülen, die zweite Phase vor allem aus neu gebildetem Insulin.[13]
Das C-Peptid wird erst bei Anstieg des Blutzuckerspiegels aus dem Proinsulin durch Peptidasen herausgeschnitten und gemeinsam mit dem aktiven Insulin und Zink ausgeschüttet. Durch den Nachweis von C-Peptid im Serum kann die endogene Insulinproduktion gemessen werden. So kann bei Diabetikern eine Aussage darüber getroffen werden, wie viel Insulin noch vom Körper selbst hergestellt wird, da das synthetische Produkt keine C-Sequenz enthält.[14]
Regulierung
Die Hauptaufgabe von Insulin besteht darin, im Zusammenwirken mit Glukagon den Blutglukosespiegel ständig zwischen bestimmten Werten zu halten. Gerät der Blutzuckerspiegel unter einen gewissen Wert droht das hypoglykämische Koma und der Tod, gerät er darüber, drohen Schäden an Gefäßen, Nierenkörperchen und anderen Geweben. Zusammen mit Leptin scheint Insulin aber auch maßgeblichen Anteil an der Energiehomöostase zu haben. Dabei wirkt aber nicht nur Leptin auf Insulin ein, sondern das Insulin wirkt selbst ebenfalls auf das Leptin ein, genau auf die Aufnahme von Leptin im Gehirn.Aufgrund der lebenswichtigen Funktion muss die biochemische Implementierung des Regelkreises robust sein. Da Zellen nicht „denken“ können, kann es nur so sein, dass Einzelzellen wie ein Zustandsautomat funktionieren bzw. dass wenige Zellen dermaßen zusammenwirken, dass ein Reiz sinnvoll verrechnet wird.
Der Hauptreiz zur Ausschüttung von Insulins aus der β-Zelle ist der Blutzuckerspiegel (ab 5 mmol Glucose/l Blut), und dieser wird direkt von der β-Zelle „gemessen“. Biochemisch umgesetzt wird das mit Hilfe von ATP-gesteuerten Kaliumkanälen, etc., siehe #Glukosegesteuerter Freisetzungsmechanismus.
Die Hormone Gastrin, Sekretin, GIP und GLP-1 modifizieren den grundlegenden Glukose-Insulin-Regelkreis indem sie auf die β-Zelle wirken. Siehe Inkretin-Effekt.
GIP wird von K-Zellen, welche sich in der Schleimhaut des Duodenums befinden und die Glukose im Chymus „messen“, ins Blut sezerniert und erhöht die Insulinausschüttung der β-Zellen. Das GIP wirkt also auf die β-Zellen zu einem Zeitpunkt ein, wo die Glukose aus der Nahrung noch nicht ins Blut gelangt ist.
GLP-1 wird von L-Zellen, welche sich in der Schleimhaut des Ileum und des Caecum befinden und die Glukose im Chymus „messen“, ins Blut sezerniert und erhöht ebenfalls die Insulinausschüttung der β-Zellen. Der Großteil der Nährstoffe wird bereits im Jejunum extrahiert und ins Blut bzw. in die Lymphe abgegeben. Im Caecum findet keinerlei Absorption von Nährstoffen, sondern hauptsächlich eine Fermentation statt.
Zusätzlich sind β-Zellen sowohl vom parasympathischen als auch sympathische Nervensystem innerviert:
Das parasympathische NS wird bei Leptin-Insuffizienz (oder auch bei Leptin-Resistenz) aktiviert und wirkt allgemein trophotropisch, d. h., es bewirkt die Speicherung von Energie. Es erhöht also die Insulinabgabe. Zumindest bei Mäusen wirkt es außerdem gleichzeitig auf Adipozyten ein und erhöht ihre Empfindlichkeit für Insulin, während die Empfindlichkeit der Leber- und Muskelzellen nicht beeinflusst wird. Glukose wird in Leber- und Muskelzellen zu Glykogen verbaut und derart gespeichert, in den Adipozyten erfolgt De-novo-Lipogenese und Speicherung von TGs.
Das sympathische NS wird bei Leptin-Suffizienz aktiviert und wirkt allgemein ergotropisch, d. h., es bewirkt die Erhöhung des Energieverbrauchs. Es senkt die Insulinabgabe. Die Senkung der Insulinabgabe scheint einem erhöhten Energieverbrauch entgegenzuwirken, denn die Muskelzellen können sehr viel mehr Glukose aus dem Blut aufnehmen, wenn sie möglichst viele GLUT-4 Transporter auf der Oberfläche aufweisen. Sie müssen also auf die bereits gespeicherte Energie in Form von Glykogen und Fettsäuren zurückgreifen.
Glukosegesteuerter Freisetzungsmechanismus
Im Bild die Schwankungen des Blutzuckers (rot) und das den Blutzucker kontrollierende Hormons Insulin (blau) beim Menschen über den Tagesablauf mit drei Mahlzeiten. Aufgezeigt auch ist der Einfluss einer zuckerhaltigen (gestrichelt) gegenüber einer stärkehaltigen (durchgezogene Linie) Mahlzeit.[15]
Ablauf der glukosegesteuerten Insulinfreisetzung
Die gespeicherten Insulinmoleküle werden durch Verschmelzen der Membranen (Exozytose) aus den β-Zellen in den Extrazellularraum und weiter in den Blutkreislauf freigesetzt. Dabei werden die Speicher-Hexamere aufgetrennt. Der Insulinspiegel im Blut steigt an.
Halbwertszeit und Abbau
Die biologische Halbwertszeit einzelner Insulinmoleküle im Blutkreislauf liegt bei circa fünf Minuten.[12]Das Insulin wird über manche Insulinrezeptoren in die Zellen aufgenommen, dort abgebaut und somit verbraucht. In der Leber und in der Niere wird Insulin durch Insulinase inaktiviert, die Insulinase oder genauer Glutathion-Insulin-Transhydrogenase spaltet die Disulfidbrücken zwischen der A- und der B-Kette auf, wodurch das Insulin in zwei Teile zerfällt und wirkungslos wird.[16] Die Abbauprodukte werden durch die Niere ausgeschieden, ebenso 1,5 % des noch intakten Insulins.[17] Die kurze Zeitspanne der Aktivität des Insulins zeigt, dass die physiologische Steuerung des Zuckerstoffwechsels im gesunden Körper sehr schnell funktioniert; diese Geschwindigkeit kann bei der Behandlung des Diabetes mellitus praktisch nicht erreicht werden.
Insulin als Arzneistoff
Wirkungsprofil verschiedener Insulinpräparationen bzw. Insulinanaloga nach subkutaner Injektion
- sehr schnell und kurz wirkend: Insulin glulisin, Insulin lispro, Insulin aspart
- kurz wirkend: Normalinsulin (= gelöstes Humaninsulin)
- intermediär wirkend: NPH-Insulin, biphasisches Insulin lispro, biphasisches Insulin aspart
- lang wirkend: Insulin detemir, Insulin glargin, Insulin degludec
In der Vergangenheit wurde Insulin im Rahmen der Insulinschocktherapie zur Behandlung von Menschen mit psychischen Krankheiten eingesetzt. Diese Methode der Behandlung wurde zum Beispiel im biografischen Film A Beautiful Mind an John Nash praktiziert. Dieses Verfahren wird nicht mehr praktiziert.
Missbrauch von Insulin
Insulin steht auf der Liste der verbotenen Doping-Substanzen,[19] da es zu mehreren Zwecken missbraucht werden kann. Da Insulin der durch Somatropin verringerten Glukoseaufnahme in die Muskelzellen entgegenwirkt, wird es oft zur Kompensation dessen unerwünschter Nebenwirkung verwendet (siehe Anabolikum). Andere Anwendungen sind die Förderung der Füllung der Glykogenspeicher bei Ausdauersportlern und die Unterstützung des Aufbaus von Muskelmasse.[20]Die missbräuchliche Selbstverabreichung von Insulin, um den Blutzuckerspiegel übermäßig abzusenken, führt zum Krankheitsbild der Hypoglycaemia f
actitia.
Im März 2008 wurde der Krankenpfleger Colin Norris in Newcastle zu einer Freiheitsstrafe von 30 Jahren verurteilt, weil er vier seiner Patientinnen durch Injektion zu hoher Insulindosen ermordet hatte.[21]
...
Der Muskel
allgemeine Informationen für Kollegen
Synonym
- musculus
Definition
- "Die Muskeln sind Organe, die die Fähigkeit besitzen, sich kontrahieren zu können… Sie leisten also mechanische Arbeit." (Herwig Hahn von Dorsche 1985)
- bauchiges Organ mit Ursprung und Ansatz, welches durch die Abfolge von Kontraktion und Erschlaffen innere und äußere Strukturen des Organismus (Gliedmaße, Rumpf, Kopf, Anhangsgebilde, Körperöffnungen, Körperhöhlen, Organe, Gefäße) nähern bzw. bewegen kann
- Grundlage der aktiven Fortbewegung, der Gestaltveränderung, der Kommunikation, vieler innerer Körperfunktionen, Blutzirkulation, Wärmebildung, (Quelle: Wikipedia)
- als System (ca. 640 Muskeln von 1mm bis 40 cm Länge und unterschiedlicher Dicke bzw. Breite) bis zu 40% des Körpergewichtes eines Erwachsenen (zur Geburt ca. 20%, je nach Krafttraining bis zu 65%)
- durch Teile des Gehirns (Cortex) bewusst, aber auch durch andere Teile wie Kleinhirn, Basalganglien und Vegetativum aber auch Rückenmark autonom (ohne Willen) innerviert bzw. gesteuert (Dauer, Länge und Frequenz der Kontraktion(en), Spannung bzw. Tonus, Reflexe)
- Namensgebung je nach Topographie, Form, Größe, Fiederung und Funktion
Embryologie
- aus Endoderm Entwicklung von Zellen, welche kontraktile Proteine (Aktin, Myosin, u.a.) produzieren (Myoblasten), sich einzeln oder in Verbänden (Synzytien) nach elektrischer Erregung (Aktionspotentiale) verkürzen (Myozyten) und dann spezifizieren
- bei Skelettmuskel aus segmentiertem und unsegmentiertem Mesoderm (Somatopleura) Differenzierung von Myotomzellen und dann Verschmelzung dieser Myoblasten über Myotuben zu Myozyten mit mehreren Zellkernen
- hier ab 8. Woche Bildung erster Myofibrillen
- ab 3. Monat erste Querstreifung aufgrund Anordnung der o.g. Filamente Aktin, Myosin usw. sichtbar
- nun Bündelung zu Fasern
- ab 5. Monat am Rumpf dorsale Anlage als Epimer und ventrolaterale Anlage als Hypomer gegliedert (immer an Spinalnerv orientiert)
- aus Epimer dorsale Muskeln, aus Hypomer ventrolaterale und Extremitätenmuskulatur (hier schon ab 7. Woche Knospenbildung zu erkennen)
- erst tiefe und proximale dann oberflächige und distale Muskeln entwickelt (Wancura-Kampik 2010)
- Kopfmuskeln folgen dem z.T. unsegmentierten Mesoderm (kraniale Somiten, Kopfmesenchym und Kiemenbögen) und werden von Nn. occulomotorius, trochlearis, trigeminus, abducens, facialis, glossopharyngeus, azzessorius und hypoglossus "verfolgt"
- ab Geburt keine Neubildung mehr, nur noch Volumenzunahme
Arten
Glatte bzw. Viszeralmuskulatur
- einzelner spindelförmiger Myozyt mit Kern, Plasma, kontraktilen
Filamenten (Aktin und Myosin) und Membran, untereinander Nexus,
innerviert durch vegetative Nervenendigungen, ständig aktiv
glatte Muskelzellen (mikroskopisches Präparat 400fach vergrößert, Institut für Anatomie der Ernst-Moritz-Arndt Universität zu Greifswald, nachgezeichnet 5.1.1988)
Herzmuskulatur
- Myozyt bzw. Verschmelzung zu Synzytium (Myofibrille) mit Filamenten (Aktin und Myosin) und charakteristische Querstreifung, aber nur ein zentraler Kern,
- zusätzlich Speicherung von Glykogen und Lipofuszin,
- weiterhin Membran und Tubuli, untereinander Nexus und Desmosome, am Ende Discus intercalaris bzw. Glanzstreifen
- http://www.unifr.ch/anatomy/elearningfree/allemand/biochemie/kardio/popup_kardio/kardiomyozyt.php
- innerviert durch interzelluläres Nervengeflecht,
- nahezu unermüdbar
Quergestreifte bzw. Skelettmuskulatur
- Faser als Synzytium mehrerer Myozyten mit Filamenten (Aktin und Myosin), welche charakteristische Querstreifung bzw. Cohnheim-Felderung
hervorbringen, mehreren randständigen Kernen und Satellitenzellen sowie
transversalen und longitudinalen Tubuli, innerviert durch einzelne
Nerven (Alpha- und Gamma-Fasern) über motorische Endplatte, enthält
diverse "Kontrollorgane" wie Muskelspindel usw., unterschiedliche
Energiespeicher (u.a. Myoglobin) bzw. Fasertypen und damit ermüdbar,
quergestreifte Muskulatur (mikroskopisches Präparat 400fach vergrößert ,Institut für Anatomie der Ernst-Moritz-Arndt Universität zu Greifswald, nachgezeichnet 5.1.1988)
Anatomie des Skelettmuskels
- tiefdunkelrote Farbe
- bei Kontraktion hart, dicker und verkürzt, bei Erschlaffung weich, schmaler und länger
- jeder Muskel hat Bauch (venter ), Ursprung (origo ) meist als punctum fixum proximal und Ansatz (insertio ) meist als punctum mobile distal innerhalb einer Faszie (fascia ) bzw. bindegewebigen Hülle
- mit jeweiligem Übergang zu Sehne (tendo ) einschl. Peritenium (ggf. sogar eingelagertem Sesambein), Kapsel (teilweise sogar intraartikuläre Muskelfasern) und Periost (Sehne, Faszie und Kapsel)
- Eintritt eines Gefäß-Nervenbündels am Hilus (Verlauf dann innerhalb bindegewebiger Faszie und Septen)
- Muskeln haben unterschiedliche Bauchformen, zeigen in der Anordnung ihrer Fasern zur Längs-, Querachse und zum Verlauf der Sehnen unterschiedlicher Fiederungen und kann man je nach Topographie (befinden sich an Gliedmaßen oft gemeinsam in so genannten Muskellogen) und Funktion (Syn- bzw. Agonisten als Helfer und Antagonisten als Gegenspieler) unterteilen (Herwig Hahn von Dorsche 1985, Müller-Wohlfahrt et al. 2010 )
- gerade (M. rectus)
- platt (M. planus), meist Sehnenplatte (Aponeurose)
- spindelförmig (M. fusiforme), ein-, zwei- (M. biceps bei parallel liegenden Bäuchen, biventer sive digastricus bei hintereinander liegenden Bäuchen), drei- (M. tricpes), vier- (M. quadricpes) oder mehrköpfig , meist parallele Fasern, Bewegungsmuskel
- quadratförmig (M. quadratus)
- dreieckig (M. triangularis)
- ringförmig (M. orbicularis)
- einseitig (M. unipennatus), meist kurze Fasern zwischen Sehnen, meist Haltemuskeln
- beidseitig (M. bipennatus)
- mehrfach (M. multipennatus) mit größerem physiologischen Querschnitt und damit Kraftentwicklung
- Beuger (M. flexor)
- Strecker (M. extensor)
- Anzieher (M. adductor)
- Abzieher (M. abductor)
- Schließer (M. sphincter)
- Erweiterer (M. dilatator)
- Heber (M. elevator)
- Spanner (M. tensor)
|
|
| (Quelle: Wikipedia) |
Histologie
- Muskelbauch mit primärem, sekundärem und tertiärem Bündel aus Fasern (<1 mm - >30 cm Länge)
- wiederum aus zahlreichen Fibrillen (ca. 1µm dicker "Schlauch") mit Filamenten Aktin (5 nm dick), Myosin (10 nm dick) und anderen Einweißen wie Troponin bzw. Tropomyosin (Sarkomer=kleinste Einheit)
- dazu Hülle (Faszie) und Septen (Endo-, Perimysium internum und externum sowie Epimysium),
aus Despopoulos A, Silbernagl S (1986)
- Zelle mit Membran bzw. Sarkolemm, mehreren randständigen Kernen (pro mm 50-100), Sarko- bzw. Zytoplasma mit Zytoskelett, Mitochondrien und endo- bzw. sarkoplasmatischem Retikulum bzw. transversale und longitudinale Tubuli
- Sarkolemm ist semipermeabel, wichtig für Regeneration, enthält Kollagen Typ IV, Fibronektin und Laminin sowie Poren, Kanäle und Rezeptoren für Verbindung zwischen endo- bzw. sarkoplasmatischem Retikulum (enthält Calsequestrin, dem Calcium-Speicher) und Matrix über transversale und longitudinale Tubuli (sakrotubuläres System)
- Mitochondrien (variable Zahl pro Faser bzw. Zelle, wobei bei Typ 1 und Sportlern mehr) unterhalb Membran bzw. I-Band, reich an Fermenten der Atmungskette, Fettsäuren, Carnithin, Cytochromoxidasen,
- Plasma enthält Speicher (Schollen, Vakuolen, Tröpfchen bzw. Lysosomen) für Energiestoffwechsel und zahlreiche Intermediärfilamente wie Troponin, Tropomyosin, Myoglobin und Aldolase im I-Band, Titin und F-Protein im A-Band, MM-Kinase im M-Band, Desmin und Vimentin im Z-Band, usw.
- Ribosomen in Nähe der motorischen Endplatte
- in einer Faser nicht nur mehrere Fibrillen, sondern pro Fibrille mehrere Filamente (jeweils ca. 2000 Aktin-Fäden und ca. 1000 Myosin-Bündel), welche Sarkomer mit Z-Scheibe als Verbindung zueinander bilden (pro Gramm Muskel 100mg kontraktile Proteine mit ca. 70% Myosin, eine ATPase (500000 Dalton) aus 2 schweren und 4 leichten umeinander gewickelte Ketten und Köpfchen, und 30% Aktin mit G-Aktin als Monomer von 42000 Dalton zu F-Aktin, den Fäden), daraus ergibt sie Querstreifung (innerhalb Z: A-Band (Länge von Myosin-Bündel), innerhalb A: H-Band (Differenz der von beiden Seiten des Myosin "herangezogene" Aktin) sowie jeweils ½ I-Band als "myosinfreie" Reserve am Rande vom Sarkomer)
- innerhalb bzw. parallele zu Faser im perifaszikulären BG Muskelspindel (wenige mm lang und 250µm dick) mit Kapsel, welche über sensible Ia- und II-Afferenzen sowie tonische und phasische Alpha-, Beta- und Gamma-Efferenzen intrafusale Fasern (Nuclear-bag- und Nuclear-chain-Fasern) und damit Muskeltonus reguliert
- ein oder mehrere periphere Nerven bilden u.a. über Alpha-Fasern eine motorische Endplatte pro Muskelfaser, Efferenzen von Golgi-Apparaten des Sehnenüberganges zum ZNS und als vegetative und andere C-Fasern von BG und Gefäßen zum Sympathikus, Endplatte selbst aus Schwann-Zellfortsatz mit Einbuchtungen, Membran, Vesikeln für Calcium und Rezeptoren für Acetylcholin (Der Nerv),
- Synapse immer gleich stark (ca. 300 Ä) da muskulär auch Faltenapparat, hier grenzt sarkoplasmatisches System und Mitochondrien an,
|
|
| aus Despopoulos A, Silbernagl S (1986) |
Physiologie
Erregung
- durch zentrales Nervensystem über Cortex (und durch Mittel-, Zwischen- und Stamm- sowie Kleinhirn beeinflusst) zu Rückenmark mit Alpha-Motoneuron bis peripherer Nerv (mit Markscheide und Axon) und seinem Neurit (bis > 1m) Impuls (60-120ms)
- ja nach Muskel von 4 bis >1000 Muskelzellen pro Motoneuron erregt
- an motorischer Endplatte bzw. Synapse Weiterleitung Impuls durch Transmitter (von prä- auf postsynaptische Membran bzw. Sarkolemm mit Rezeptor) und entsprechende biochemische Auslösung einer Kontraktion (u.a. Freisetzung von Kalzium in Zisternen, Triaden oder auch T-System des sakrotubulären Systems)
|
|
| aus Despopoulos A, Silbernagl S (1986) |
Kontraktion
- Kalzium ermöglicht erst Ruderschlag, da durch intrazelluläres Kalzium an Troponin, welches mit Tropomyosin spiralförmig um Aktin gebunden ist, Bindung der Myosinköpfe an Aktin
- innerhalb kurzer Latenzzeit (wenige Millisekunden) Aktivierung Myosin bzw. ATPase durch Magnesium und Kalzium, wodurch Wärmeenergie frei wird, ATP von Myosinköpfen gelöst und diese abgewinkelt werden
- Aktinfilament (an Z-Bande befestigt) rutscht durch Ruderschlag aufeinander zu (Gleitfilamenttheorie)
- dadurch Annäherung der Z-Scheiben Verkürzung des Sarkomers bzw. Kontraktur der Fibrille bzw. Faser
- nach Phosphorylierung von ADP zu ATP (u.a. anaerob: pro Kreatin(in)phosphat 1 ATP und pro Glycogen unter Verbrauch von 2 ATP und Entstehung von 2 Laktat 4 ATP sowie aerob pro Zitratzyklus unter Verbrauch von 6 O2 und Entstehung von 6 CO2 und H2O 34 ATP) Bindung an Myosinköpfe und Lösung von Aktin (Erschlaffung)
- ATP ermöglicht Lösung der Querbrücken für neuen Ruderschlag (vgl. Totenstarre)
- nun wieder Kalziumeinstrom unter Anwesenheit von Magnesium und Phosphate (Myoglobinspeicher) bzw. "Blut" und Abtransport von Kreatinin, Laktat, Kohlendioxid sowie Wasser
- pro motorische Endplatte bzw. Einheit entweder mehrere Salven (von wiederholter Kontraktion über Haltearbeit bzw. Krampf) oder Erschlaffung
- bei Kontraktion Ökonomisierung durch Rekrutierung nacheinander "eingeschalteter" Einheiten während Kontraktion ohne Krampf
- je nach Anforderung zentrales An- und Abschalten mit Synchronisation von max. 80-90% der Fasern bei Überforderung (Zittern)
- bei Erschlaffung und unauffälliger Anatomie Tonus als Ergebnis einer Spannung aller Fasern (abhängig vom Sympathikus, Muskel- und Sehnenspindel, kontraktile Proteine und Enzyme, Minerale und Energiespeicher bzw. -stoffwechsel, großer Einfluss von ZNS (Kleinhirn, Mittel- und Zwischenhirn, limbisches System, Cortex usw.))
- Tonusregulation auch durch Psyche und Extrapyramidales System
- bei Tonuserhöhung Rigor möglich (Das vegetative Nervensystem)
- bei Ermüdung auch Anstieg des Tonus (Hypertonus, Hyperfascillitation)
- im Tiefschlaf sowie Störung der o.g. Tonusfaktoren Herabsetzung des Tonus (Hypotonus, Hypofascillitation, Weekness) (applied kinesiology bzw. AK)
Energie
Muskel- bzw. Fasertypen- langsam kontrahierende (slow twitch bzw. ST) mit ca. 75ms, nahezu unerschöpfliche rötere Fasern, sehr viele Mitochondrien, Myoglobin, Kapillaren, Fettspeicher, Enzymen des aeroben KH-Stoffwechsels, aber wenig Kraft pro Kontraktion, kleine Endplatten, wenig Phosphat und ATP-ase, hier aerobe Phophorylierung zu ATP unter Verbrauch von O2 und Entstehung von CO2 sowie H2O
- schnell kontrahierende (fast twitsch bzw. FT) und sehr schnell ermüdbare weißere Fasern mit Unterscheidung in
- oxidativ aerob bzw. FTO mit ca. 30ms, mäßig viele Mitochondrien, Myoglobin, Kapillaren, Fettspeicher und Enzyme, wobei auch die des anaeroben Stoffwechsels, aber viel KH gespeichert, hier anaerobe Phophorylierung zu ATP aus Kreatin(in)phosphat und Glycogen unter Verbrauch von zunächst ATP und schließlich Gewinnung von ATP unter Entstehung von Laktat sowie auch aerobe Phosphorylierung (siehe ST-Fasern)
- glykolytisch anaerob bzw. FTG mit ca. 20ms (noch schneller ermüdbar), aber sehr große Kraft pro Kontraktion, große Motoneurone und Endplatten, wenig Mitochondrien, Myoglobin und Kapillaren, jedoch viele Phosphate, ATP-ase, KH und Enzyme des anaeroben Stoffwechsels, hier nur anaerobe Phophorylierung wie oben aus Kreatin(in)phosphat und Glycogen unter Entstehung von Laktat
- Aufteilung genetisch festgelegt und nach Pubertät kaum veränderlich
- Übergang von Typ II zu I und umgekehrt quasi nicht mgl. (cave: Extrembedingungen)
- ST mehr bei Langstrecken- bzw. Ausdauersportler, und FT mehr bei Sprintern und Werfern, dazwischen Breitensportler
- Training (Schnelligkeit) von FTO zu FTG möglich
- Schonung einschl. Ruhigstellung im Gips o.ä. sowie Schwerelosigkeit fördern Abnahme Querschnitt, Elastizität, Tonus, Kraft, Kapillaren, Mitochondrien, Enzyme und Substrate
Regulation
Mechanik- Kraft eines Muskels entspricht Summe aller Zug- bzw. Kontraktionskräfte aller Fasern, also Querschnitt (nicht anatomisch, sondern physiologisch, was durch schrägen Verlauf oder intramuskuläre Sehnen und Septen verstärkt wird) mit bis zu 40N pro cm2
- Muskelkraft auch von Rekrutierung der Fasern und Frequenz des AP abhängig (je nach Anforderung zentrales An- und Abschalten mit Synchronisation von max. 80-90% der Fasern bei Überforderung mit Zittern)
- bei (Vor)dehnung plastisch-elastische Verformung und Optimierung der Kraftentwicklung (Ruhedehnungskurve), da parallel geschaltete Elemente angespannt sind (ca. 2,2µm Sarkomer-Länge) und Verschlechterung bei Überdehnung (ca. 3,6µm) und minimaler Länge (<1,5µm)
- durch Dehnung seriell geschalteter Elemente isometrische Kontraktion und schließlich nach Erreichen der notwendigen Kraft isotonische Kontraktion (Unterstützungskontraktion) für Verrichten der Arbeit möglich
- weitere Kontraktionsformen (konzentrisch (neben isotonisch isokinetisch und auxotonisch), schließlich exzentrisch mit erhöhter Wahrscheinlichkeit von "Muskelkater"
- je größer die Belastung, desto geringer die Verkürzung
- bei maximaler isometrischer Kontraktion Hypertrophie
- erhöhte Wärmeproduktion durch Erniedrigung der mechanischen Arbeit bei Erhöhung der chemischen Energie (Erhöhung der AP bei Tonuserhöhung und Tetanus) möglich (Muskelzittern bei Frieren und Schüttelfrost)
- Verkürzungs- bzw. Kontraktionsgeschwindigkeit nach Hill in Ruhe bzw. ohne Last, dagegen Leistung ebenso wie Arbeit bei mittlerer Belastung am größten (Schmidt und Thews 1995)
- über elektrischen Reiz (Aktionspotential) erfolgt Einzelzuckung (vgl. Reflex nach Pawlow)
- erst durch mehrere Einzelzuckungen entsteht Kontraktionswelle
- willkürliche Aktion ergibt Summation von Kontraktionswellen
- Faser hat Refraktärzeit, in der die "neue" Kontraktion vorbereitet wird und bei neuem Reiz innerhalb der Einzelzuckungszeit eine Tetanie auftreten kann (jedoch fließender Übergang von unvollständiger zu vollständiger Tetanie)
- bei externen Reizen (z.B. Elektrotherapie Elektrotherapie und Ultraschall) entspricht die Stromstärke, welche bei langer Einwirkungszeit gerade noch Kontraktion auslöst, der Rheobase und nach Titow die Zeit bis zur Kontraktion bei doppelter Rheobase Chronaxie (Badtke 1999)
- weitere Regulierung durch Rekrutierung von motorischen Einheiten durch ZNS, so in Augenmuskeln pro Muskel zahlreiche motorische Einheiten mit wenig Fasern pro Einheit (ca. 5) und geringer Kraftentwicklung und in Extremitätenmuskeln umgekehrt (ca. 2000)
- Endpunkt Synchronisation von max. 80-90% der Fasern bei Überforderung (Zittern)
- Kontraktionen erzeugen Wärme(energie), so Erhaltungswärme, initiale Wärme und Erholungswärme
- Unterschied bis zu 1000fach
- Wirkungsgrad unterschiedlich, da chemische Energie durch Phosphorylierung von ADP zu ATP = Summer von mechanischer Energie und Wärme
- effektiver bei kurzer mechanischer Leistung ohne Erholung in warmen Bedingungen und umgekehrt
- Sauerstoffverbrauch jedoch abhängig von Fasertyp und Leistungsaufgabe (bis zu 100fach beim Ausdauersport)
- Myoglobingehalt zuständig für Sauerstoffaufnahme bzw. -speicherung intrazellulär
- wenn viel Myoglobin (rote Muskeln mit Typ I-Fasern) zwar langsamere Kontraktion, jedoch geringerer Ermüdbarkeit bei ernergiesparendem oxidativen Stoffwechsel mit wenig ATP-ase und LDH (z.B. Rumpfmuskulatur, M. soleus)
- wenn wenig Myoglobin (weiße Muskeln mit Typ II-Fasern) zwar schnellere Kontraktion, jedoch schnellere Ermüdbarkeit bei aufwendigem glykolytischen Stoffwechsel mit hoher ATP-ase und LDH (z.B. M. biceps brachii)
- Energie-Lieferanten sind Kreatinphosphat, Glucose (welches anaerob über Pyruvat zu Lactat oder aerob über Pyruvat zu Kohlendioxid und Wasser abgebaut wird) und Triglyceride
- Ermüdung entspricht einer intrazellulären Acidose durch Metabolite und zeigt sich im erhöhten Tonus (Muskelverspannung bzw. Myogelose, Muskelschwäche bzw. Myopathie)
Wissenschaftliche Beschreibung
Myoglobin ist ein Häm-basiertes, globuläres, einkettiges Protein aus 153 Aminosäuren mit einer Molekülmasse von 17.053 Dalton (17 kDa), das die Fähigkeit besitzt, Sauerstoff (O2) reversibel zu binden. Die Sekundärstruktur des Proteins besteht aus insgesamt acht α-Helices.Unter physiologischen Bedingungen liegt es als Monomer vor. Das aktive Zentrum des Myoglobins ist ein Häm b, d. h. ein Protoporphyrin IX mit einem über die vier inneren Stickstoffe ligierten Eisen(II)-Ion. Das Häm ist über ein axial an das zentrale Eisenion koordiniertes, proximales Histidin an die Proteinmatrix gebunden. Die zweite axiale Position dient der Bindung des Sauerstoffmoleküls.
Im Gegensatz zum strukturverwandten Hämoglobin bindet Myoglobin den Sauerstoff nicht positiv kooperativ, sondern unabhängig von der Sauerstoffkonzentration der Umgebung.
Das Vorkommen von Myoglobin ist auf Herz- und Skelettmuskelzellen von Säugetieren beschränkt. Hier liegt es in hohen Konzentrationen (bis etwa 100 µmol/l) vor und gibt dem Muskelgewebe seine rote Farbe. Die Sauerstoffaufnahme kann gut absorptionsspektroskopisch verfolgt werden, die charakteristische Soret-Bande des Häm verschiebt sich bei Sauerstoffaufnahme deutlich von 418 zu 434 nm.
Myoglobin zählt zu den Globinen. Dem Myoglobin nah verwandt ist das erst 2002 beschriebene Cytoglobin,[1] welches in nahezu allen Zellen der Wirbeltiere vorkommt. Es dient vermutlich ebenso als Sauerstoffspeicher in der Zelle. Es scheint sogar, dass Myoglobin wohl während der Evolution durch eine Genduplikation die muskelspezifische Variante des Cytoglobins geworden ist.
Bedeutung
Als biologische Funktion wird der Sauerstoff-Transport innerhalb der Zelle, von der Zellmembran zu den Mitochondrien, angesehen. Aus diesem Grund ist seine Affinität zum Sauerstoff auch höher als bei Hämoglobin, dies fördert den Sauerstofftransport in Richtung Zellinneres. Auch die beim Hämoglobin beobachtete Regulation der Sauerstoffaffinität fehlt dem Myoglobin. Zumindest bei Meeressäugetieren wird auch die Sauerstoff-Speicherung diskutiert: Wale haben einen etwa 5- bis 10-mal höheren Myoglobin-Gehalt in ihrer Muskulatur als Landsäugetiere. Beim Menschen enthalten die Muskeln etwa 6 Gramm Myoglobin pro Kilogramm, beim Seehund sind es 52, beim Pottwal sogar 56 Gramm. Dort dient es den Meeressäugern beim Tauchen als Sauerstoffvorrat.[2]Das Myoglobin des Pottwals war daher auch das erste Protein, an dem John Kendrew 1958 eine Strukturaufklärung (Röntgenstrukturanalyse) gelang.[3] Diese Pionierleistung war Grundlage für die spätere Aufklärung der Hämoglobin-Struktur durch Max Perutz (1959).[4] Beide Wissenschaftler erhielten 1962 den Nobelpreis für Chemie.
Bedeutung in der Medizin
Ein Anstieg der Myoglobinkonzentration im Blutserum von Säugetieren kann aufgrund von Rhabdomyolyse als Indikator für einen Herzinfarkt gelten. Da ein erhöhter Myoglobinwert aber unspezifisch ist, verwendet man heute die Creatinkinase zur Herzdiagnostik. Weiterhin zeigen sich erhöhte Myoglobinwerte bei Schädigung der Skelettmuskulatur (extremer Sport, epileptische Anfälle, Polytrauma, intramuskuläre Injektionen, Alkoholintoxikation, Muskelerkrankungen, Verschüttungen (z. B. bei Erdbeben)); diese können bei extrem erhöhten Werten zu einem akuten Nierenversagen führen (Crush-Niere).[5][6]Die Plasmahalbwertszeit von Myoglobin beträgt nur 10 bis 20 min, da es rasch über die Nieren ausgeschieden wird (glomeruläre Filtration). Der Myoglobinwert steigt bei einem Herzinfarkt nach ca. 1–2 Stunden an und erreicht sein Maximum nach 4–6 Stunden. Bereits innerhalb von 12–24 Stunden sinkt es wieder in den Normbereich ab.
Normwerte beim Menschen im Blut:[7] Frauen bis 35 µg/l, Männer bis 55 µg/l
Normwert beim Menschen im Urin: Frauen und Männer bis 0,3 mg/l









Keine Kommentare:
Kommentar veröffentlichen